Ampiamente prescritto ed utilizzato in Italia, in molti stati europei il nimesulide è stato sospeso a causa di irreversibili danni al fegato provocati da gravi reazioni avverse. Ecco cosa c’è da sapere quando assumiamo questo farmaco.
Il nimesulide è anche noto con il nome commerciale Aulin®, Mesulid® o Sulidamor®.
Il nimesulide appartiene alla classe dei farmaci FANS (Farmaci Antinfiammatori Non Steroidei), utilizzato prevalentemente in terapia per il suo buon effetto antidolorifico ed antinfiammatorio. Il farmaco è prescritto per curare i dolori osteoarticolari, i dolori da trauma muscolare (stiramenti o strappi), per dismenorrea primaria e dolori mestruali.
Breve storia del farmaco
Nimesulide è stato sintetizzato per la prima volta dalla multinazionale 3M negli Stati Uniti come farmaco sperimentale per la cura del cancro, ma il pessimo profilo di sicurezza, se somministrato alle dosi necessarie per ottenere tale effetto, ha portato l’azienda a rinunciare all’impresa.
Composizione chimica del nimesulide
Il farmaco fu così destinato alla terapia antinfiammatoria e venduto alla società svizzera Helsinn Healthcare SA che a sua volta lo diede in licenza alla Boehringer Mannheim con il nome di Aulin® nel 1985.
Nel 1985 la Boehringer Mannheim ottenne rapidamente l’autorizzazione all’immissione in commercio dal Ministero della Sanità italiano e proprio l’Italia fu il primo stato a distribuire sui banchi farmaceutici il nimesulide, dalle cui vendite fu generato un fatturato che ha sfiorato i 40 milioni di euro annui nei primi anni 2000.
Dopo il 1985 il nimesulide fu approvato in altri 50 stati, ma gli Stati Uniti, che per la prima volta lo sintetizzarono, la Gran Bretagna, Canada, Giappone, Australia e Nuova Zelanda non approvarono mai l’uso di questo farmaco a causa della gravità delle reazioni avverse.
Nel 1998 Boehringer Mannheim fu acquistata dalla società farmaceutica svizzera Roche.
In seguito alle numerose segnalazioni di gravi reazioni avverse comparse in concomitanza all’uso di nimesulide, quali intolleranza, allergia o manifestazioni idiosincrasiche violente, le autorità sanitarie di ciascuna nazione hanno riesaminato il profilo di sicurezza ed il rapporto rischio/beneficio del farmaco per arrivare, in alcuni paesi, alla sospensione temporanea del farmaco o il suo ritiro definitivo dal commercio.
In Italia, nella Rete Nazionale di Farmacovigilanza, sono inserite 738 segnalazioni di sospette reazioni avverse al nimesulide insorte tra il 1 gennaio 2001 al 17 maggio 2007; di queste segnalazioni 360 (48,8%) sono costituite da casi gravi, 19 (2,6%) sono state fatali.
In merito alla distribuzione per sesso, 438 casi riguardano le donne e 298 gli uomini; in due casi non è stato riportato il sesso nella scheda di segnalazione. La distribuzione per fascia d’età nei pazienti > di 12 anni mostra che 29 casi sono relativi alla fascia 13-18 anni, 248 alla fascia 19-40 anni, 234 alla fascia 41-60 anni, 110 alla fascia 61-70 anni, 79 alla fascia 71-80 anni ed infine 30 sono relative a pazienti > di 80 anni.
I dati inseriti in Tabella 1 mostrano come i disordini epatobiliari risultino la terza causa più frequente di reazioni avverse (ADR) associata all’uso di tale farmaco.
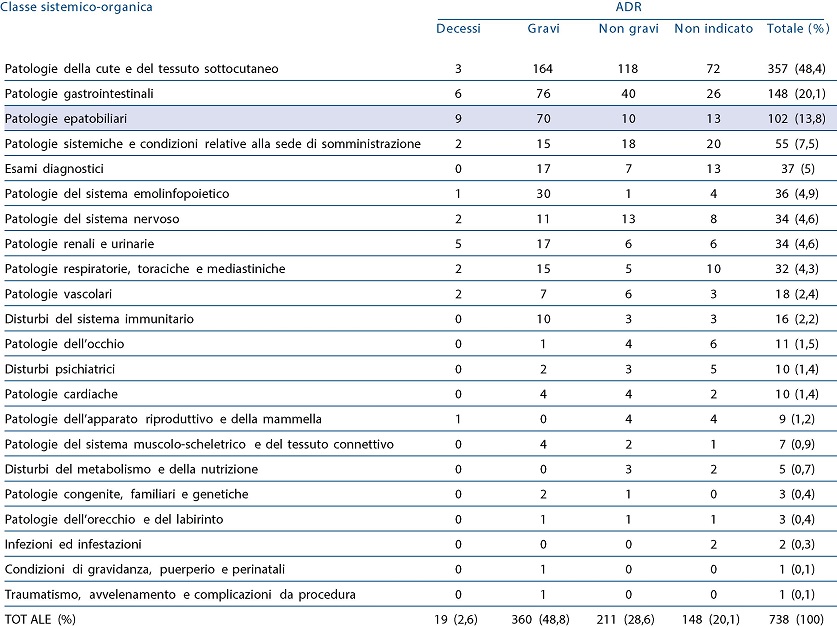
Tabella 1 – Nimesulide: distribuzione delle reazioni avverse per classe sistemico-organica.
Centodue segnalazioni riguardano reazioni epatobiliari: di queste 9 casi sono stati fatali, 70 gravi, 10 non gravi ed in 13 la gravità non è stata riportata. In merito alla tipologia di epatopatia conseguente all’uso di nimesulide, le principali reazioni gravi segnalate sono state epatite acuta (31), epatite (15), epatite colestatica (12), epatite fulminante (6).
L’uso del nimesulide nella maggioranza dei casi è stato di breve durata (da 1 a 8 giorni), le esposizioni superiori al mese sono state molto limitate.
In 20 casi gravi oltre al nimesulide era riportata la presenza di altri farmaci sospettati di aver causato la reazione, mentre in 29 segnalazioni era riportato l’uso concomitante di altri medicinali. In entrambi i casi spesso il farmaco nimesulide era associato ad altri medicinali potenzialmente in grado di dare tossicità epatica quali ad esempio paracetamolo, antibiotici macrolidi o altri FANS (Fonte: AIFA, Bollettino d’Informazione sui Farmaci 3/2007).
Nonostante queste evidenze il 20 maggio 2007 in sede EMEA (agenzia europea dei medicinali), è stato il voto dell’Italia a salvare il nimesulide dal ritiro dal commercio del farmaco.
Nel 2002 il nimesulide fu ritirato dal commercio in Finlandia, in seguito alle numerose reazioni avverse a carico delle funzioni epatiche segnalate dai finlandesi; l’anno successivo fu ritirato dal commercio in Spagna, mentre nel 2007 anche in Irlanda il nimesulide fu sospeso definitivamente dai banchi farmaceutici.
Nimesulide o altri FANS?
Dall’analisi dei risultati di farmacovigilanza valutati dagli esperti dell’AIFA (Agenzia Italiana del Farmaco) è emerso che il nimesulide non ha un profilo di sicurezza superiore a quello di altri FANS, ma al contrario possiede un inferiore profilo di tollerabilità epatica.
Inoltre, essendo il nimesulide un FANS, rimangono a carico di questa sostanza tutti gli altri effetti collaterali tipici dei FANS, quali ulcere peptiche, perforazione delle mucose gastrica e duodenale o emorragia gastrointestinale, a volte purtroppo fatale, negli anziani.
Tuttavia il nimesulide è maggiormente selettivo per le COX-2 piuttosto che per le COX-1 (vedi FANS e meccanismo d’azione), e quindi ha minor impatto negativo con le mucose gastroduodenali, riducendo il numero di ospedalizzazioni per sanguinamento gastrico.
Secondo uno studio italiano condotto da Venegoni e colleghi (2010), attraverso una simulazione, è stato stimato il numero atteso di ospedalizzazioni per epatopatie e per sanguinamenti gastroduodenali in Italia, nel 2006 e 2009, tenendo conto di un possibile spostamento delle prescrizioni di nimesulide verso altri farmaci antinfiammatori non steroidei (FANS). La frequenza attesa di ospedalizzazione, prima e dopo le misure restrittive adottate dall’agenzia europea del farmaco (EMEA) sull’utilizzo del nimesulide è stata calcolata in base ai dati di altri due studi epidemiologici.
I risultati suggeriscono che avendo ridotto l’uso del nimesulide potrebbe avere evitato 79 ricoveri per danno epatico, ma avere incrementato i ricoveri per sanguinamenti gastroduodenali di 859 casi.
Queste simulazioni presentano tuttavia diverse limitazioni poiché non vengono valutati gli esiti delle ospedalizzazioni provocate dallo specifico farmaco e la gravità delle reazioni avverse, considerando esclusivamente l’aspetto economico ed il costo delle singole ospedalizzazioni. Inoltre questo studio ha preso in esame le sole ospedalizzazioni causate da epatopatie e sanguinamenti gastroduodenali, senza considerare ospedalizzazioni causate da altri effetti collaterali associati all’utilizzo sia di FANS sia di nimesulide, in particolar modo a carico del sistema cardiovascolare (emorragie o eventi trombotici come infarto ed ictus).
Altri effetti collaterali provocati dall’utilizzo di nimesulide sono: nausea, vomito, diarrea, flatulenza, costipazione, dispepsia, dolore addominale, stomatiti ulcerative, esacerbazione di colite e morbo di Crohn. Meno frequentemente sono state osservate gastriti.
Altri eventi avversi riguardano il sistema nervoso: vertigini, mal di testa, sonnolenza ed encefalopatia; cute e tessuto sottocutaneo: prurito, eruzioni, aumento della sudorazione, eritema, dermatite; sistema renale e vie urinarie: disuria, ematuria, ritenzione urinaria, insufficienza renale; alterazione del sangue e del sistema vascolare: ipertensione, fluttuazione della pressione arteriosa, emorragia, vampate di calore, anemia, eosinofilia; disturbi psichiatrici: ansia, nervosismo, incubi.
Secondo le attuali prescrizioni mediche, per ridurre gli effetti indesiderati e l’insorgere di reazioni avverse con l’utilizzo di nimesulide, deve essere utilizzata la dose minima efficace e per il minor tempo possibile. La durata massima del trattamento è di 15 giorni ad un dosaggio di 100 mg due volte al giorno. La decisione di prescrivere nimesulide deve essere basata su una valutazione dei rischi individuali complessivi del paziente.
Tossicità epatica da nimesulide
Il danno epatico è riferito dall’esame istologico e si mostra come necrosi centrolobulare.
Sono riportate incursioni di eosinofili soprattutto nelle prime fasi durante l’insorgenza del danno. Sia il meccanismo immunologico sia idiosincrasico sono coinvolti nella genesi del danno epatico; è probabile che le reazioni di tossicità coinvolgano alcuni metaboliti del nimesulide attivati dagli enzimi del fegato ed una sindrome immunologica come parte della sindrome reattiva metabolica. Sfortunatamente, come succede in molti casi con altri farmaci, mancano dati sperimentali che facciano piena luce sui meccanismi di tossicità del nimesulide.
Fonti
– Sito internet AIFA (Agenzia Italiana del Farmaco) https://www.aifa.gov.it/

